التركيب الذري والجزيئي
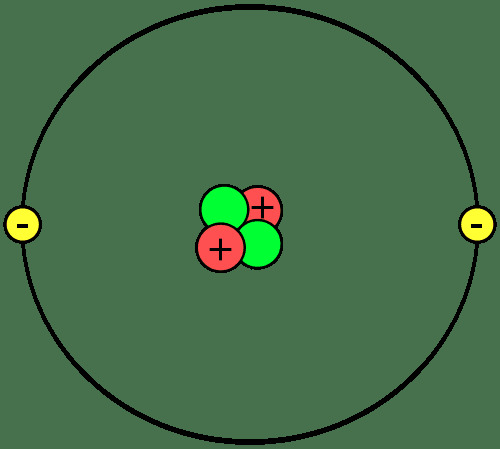
اللبنات الأساسية للمادة هي الذرات التي تتحد معًا لتكوين جزيئات أو مركبات. من المهم معرفة أجزاء الذرة ، أي الأيونات والنظائر ، وكيف تتحد الذرات معًا.
أجزاء الذرة
تتكون الذرات من ثلاثة مكونات:
- البروتونات - شحنة كهربائية موجبة
- النيوترونات - بدون شحنة كهربائية
- إلكترونات - شحنة كهربائية سالبة
تشكل البروتونات والنيوترونات النواة أو مركز كل ذرة. تدور الإلكترونات حول النواة. لذا ، فإن نواة كل ذرة لها شحنة موجبة صافية ، في حين أن الجزء الخارجي للذرة لديه شحنة سالبة صافية. في التفاعلات الكيميائية ، تفقد الذرات أو تكتسب أو تشارك الإلكترونات. لا تشارك النواة في التفاعلات الكيميائية العادية ، على الرغم من أن التحلل النووي والتفاعلات النووية يمكن أن تسبب تغيرات في النواة الذرية.
الذرات والأيونات والنظائر
يحدد عدد البروتونات في الذرة أي عنصر هو. يحتوي كل عنصر على حرف واحد أو حرفين رمز يتم استخدامه للتعرف عليه في الصيغ والتفاعلات الكيميائية. رمز الهليوم هو. ذرة بروتونين هي ذرة الهيليوم بغض النظر عن عدد النيوترونات أو الإلكترونات الموجودة بها. قد تحتوي الذرة على نفس عدد البروتونات والنيوترونات والإلكترونات أو قد يختلف عدد النيوترونات و / أو الإلكترون عن عدد البروتونات.
الذرات التي تحمل شحنة كهربائية موجبة أو سالبة أيونات. على سبيل المثال ، إذا فقدت ذرة الهيليوم إلكترونين ، سيكون لها شحنة صافية تبلغ +2 ، والتي سيتم كتابتها2+.
تغيير عدد النيوترونات في الذرة يحدد أي منها النظائر عنصر ما. يمكن كتابة الذرات برموز نووية لتحديد نظائرها ، حيث يوجد عدد النيوكليونات (البروتونات والنيوترونات) مدرجة أعلاه وإلى يسار رمز العنصر ، مع عدد البروتونات المدرجة أدناه وإلى يسار رمز. على سبيل المثال ، ثلاث نظائر للهيدروجين هي:
11ح ، 21ح ، 31ح
نظرًا لأنك تعلم أن عدد البروتونات لا يتغير أبدًا لذرة عنصر ما ، فإن النظائر تُكتب بشكل أكثر شيوعًا باستخدام رمز العنصر وعدد النوى. على سبيل المثال ، يمكنك كتابة H-1 و H-2 و H-3 للنظائر الثلاثة للهيدروجين أو U-236 و U-238 لنظيرين شائعين من اليورانيوم.
العدد الذري والوزن الذري
ال العدد الذري للذرة تحدد عنصرها وعدد البروتونات. ال الوزن الذري هو عدد البروتونات بالإضافة إلى عدد النيوترونات في عنصر (لأن كتلة الإلكترونات صغيرة جدًا مقارنة مع كتلة البروتونات والنيوترونات التي لا تعد في الأساس). يسمى الوزن الذري أحيانًا بالكتلة الذرية أو عدد الكتلة الذرية. العدد الذري للهيليوم 2. الوزن الذري للهيليوم 4. لاحظ أن الكتلة الذرية لعنصر ما في الجدول الدوري ليست عددًا صحيحًا. على سبيل المثال ، يتم إعطاء الكتلة الذرية للهليوم 4.003 بدلاً من 4. وذلك لأن الجدول الدوري يعكس الوفرة الطبيعية لنظائر العنصر. في حسابات الكيمياء ، تستخدم الكتلة الذرية المعطاة في الجدول الدوري ، بافتراض أن عينة عنصر تعكس النطاق الطبيعي للنظائر لهذا العنصر.
الجزيئات
تتفاعل الذرات مع بعضها البعض ، وغالبًا ما تشكل روابط كيميائية مع بعضها البعض. عندما ترتبط ذرتان أو أكثر ببعضها البعض ، فإنها تشكل جزيءًا. يمكن أن يكون الجزيء بسيطًا ، مثل H2، أو أكثر تعقيدًا ، مثل C6ح12يا6. تشير الرموز إلى عدد كل نوع من الذرات في الجزيء. يصف المثال الأول جزيء يتكون من ذرتين من الهيدروجين. يصف المثال الثاني جزيء يتكون من 6 ذرات من الكربون و 12 ذرة من الهيدروجين و 6 ذرات من الأكسجين. بينما يمكنك كتابة الذرات بأي ترتيب ، فإن الاتفاقية هي كتابة الماضي المشحون بإيجابية للجزيء أولاً ، يليه الجزء المشحون بالسالب من الجزيء. لذا ، كلوريد الصوديوم مكتوب NaCl وليس ClNa.
ملاحظات الجدول الدوري ومراجعته

الجدول الدوري أداة مهمة في الكيمياء. تستعرض هذه الملاحظات الجدول الدوري ، وكيفية تنظيمه ، واتجاهات الجدول الدوري.
اختراع وتنظيم الجدول الدوري
في عام 1869 ، دميتري مندليف نظم العناصر الكيميائية في جدول دوري يشبه إلى حد كبير الجدول الذي نستخدمه اليوم ، باستثناء عناصره تم ترتيبها وفقًا لزيادة الوزن الذري ، بينما تم تنظيم الطاولة الحديثة عن طريق زيادة الذرة رقم. الطريقة التي يتم بها تنظيم العناصر تجعل من الممكن رؤية الاتجاهات في خصائص العنصر والتنبؤ بسلوك العناصر في التفاعلات الكيميائية.
يتم استدعاء الصفوف (الانتقال من اليسار إلى اليمين) فترات. تشترك العناصر في فترة ما في نفس أعلى مستوى للطاقة لإلكترون غير مستثير. هناك المزيد من المستويات الفرعية لكل مستوى طاقة مع زيادة حجم الذرة ، لذلك هناك المزيد من العناصر في فترات أبعد أسفل الجدول.
تشكل الأعمدة (من الأعلى إلى الأسفل) أساس العنصر مجموعات. تشترك العناصر في المجموعات في نفس العدد من إلكترونات التكافؤ أو ترتيب غلاف الإلكترون الخارجي ، مما يعطي العناصر في المجموعة العديد من الخصائص المشتركة. أمثلة على مجموعات العناصر هي الفلزات القلوية والغازات النبيلة.
اتجاهات الجدول الدوري أو الدورية
يتيح تنظيم الجدول الدوري رؤية الاتجاهات في خصائص العناصر في لمحة. تتعلق الاتجاهات المهمة بنصف قطر ذري ، وطاقة تأين ، وسلبية كهربائية ، وألفة إلكترونية.
-
نصف القطر الذري
يعكس نصف القطر الذري حجم الذرة. نصف القطر الذري يقلل من الانتقال من اليسار إلى اليمين عبر فترة و يزيد الانتقال من الأعلى إلى الأسفل أسفل مجموعة عنصر. على الرغم من أنك قد تعتقد أن الذرات ستصبح ببساطة أكبر لأنها تكتسب المزيد من الإلكترونات ، إلا أن الإلكترونات تبقى في غلاف ، في حين أن العدد المتزايد من البروتونات يسحب الأصداف أقرب إلى النواة. بالانتقال لأسفل مجموعة ، تم العثور على الإلكترونات أبعد من النواة في قذائف الطاقة الجديدة ، لذلك يزداد الحجم الكلي للذرة. -
طاقة التأين
طاقة التأين هي كمية الطاقة اللازمة لإزالة الإلكترون من أيون أو ذرة في حالة الغاز. طاقة التأين يزيد الانتقال من اليسار إلى اليمين عبر فترة و يقلل من الانتقال من الأعلى إلى الأسفل أسفل مجموعة. -
كهرسلبية
السالبية الكهربية هي مقياس لمدى سهولة تكوين الذرة لرابطة كيميائية. كلما زادت السالبية الكهربية ، زاد جاذبية ربط الإلكترون. كهرسلبية يقلل من تحريك مجموعة العناصر إلى أسفل. تميل العناصر الموجودة على الجانب الأيسر من الجدول الدوري إلى أن تكون إيجابية أو أكثر احتمالًا للتبرع بإلكترون من قبولها. -
الإلكترون تقارب
يعكس تقارب الإلكترون مدى سهولة قبول الذرة للإلكترون. الإلكترون تقارب يختلف باختلاف مجموعة العناصر. الغازات النبيلة لها تقارب إلكترون بالقرب من الصفر لأنها ملأت قذائف الإلكترون. الهالوجينات لها تقارب إلكترون مرتفع لأن إضافة إلكترون يعطي ذرة غلاف إلكترون مملوء بالكامل.
الروابط والربط الكيميائي

الروابط الكيميائية يسهل فهمها إذا كنت تضع في الاعتبار الخصائص التالية للذرات والإلكترونات:
- تبحث الذرات عن التكوين الأكثر استقرارًا.
- تنص قاعدة Octet على أن الذرات التي تحتوي على 8 إلكترونات في مدارها الخارجي ستكون أكثر استقرارًا.
- يمكن للذرات مشاركة أو إعطاء أو أخذ إلكترونات ذرات أخرى. هذه هي أشكال الروابط الكيميائية.
- تحدث الروابط بين إلكترونات التكافؤ للذرات ، وليس الإلكترونات الداخلية.
أنواع الروابط الكيميائية
النوعان الرئيسيان من الروابط الكيميائية هما الروابط الأيونية والتساهمية ، ولكن يجب أن تكون على دراية بعدة أشكال من الروابط:
-
الرابطة الأيونية
الرابطة الأيونية عندما تأخذ ذرة إلكترون من ذرة أخرى. مثال: يتكون كلوريد الصوديوم بواسطة رابطة أيونية حيث يتبرع الصوديوم بإلكترون تكافؤه إلى الكلور. الكلور هالوجين. تحتوي جميع الهالوجينات على 7 إلكترونات تكافؤ وتحتاج إلى إلكترون آخر للحصول على ثمان ثابت. الصوديوم معدن قلوي. تحتوي جميع المعادن القلوية على إلكترون تكافؤ واحد ، يتبرعون به بسهولة لتشكيل رابطة. -
سندات تساهمية
سندات تساهمية عندما تتشارك الذرات الإلكترونات. حقا ، الاختلاف الرئيسي هو أن الإلكترونات في الروابط الأيونية ترتبط ارتباطا وثيقا بذرة واحدة النواة أو غيرها ، والتي من المحتمل أن تدور الإلكترونات في رابطة تساهمية حول نواة واحدة مثل آخر. إذا كان الإلكترون يرتبط ارتباطًا وثيقًا بذرة واحدة أكثر من الأخرى ، أ الرابطة التساهمية القطبية قد تشكل. مثال: تتكون الروابط التساهمية بين الهيدروجين والأكسجين في الماء ، H2سين. -
السندات معدنية
عندما تكون كلتا الذرتين من المعادن ، تتكون رابطة معدنية. الفرق في المعدن هو أن الإلكترونات يمكن أن تكون أي ذرة معدنية ، وليس ذرتين فقط في مركب. مثال: تظهر الروابط المعدنية في عينات من معادن العناصر النقية ، مثل الذهب أو الألومنيوم ، أو السبائك ، مثل النحاس أو البرونز.
قد تتساءل كيف يمكنك معرفة ما إذا كانت الرابطة أيونية أو تساهمية. يمكنك إلقاء نظرة على موضع العناصر في الجدول الدوري أو جدول العناصر سلبيات كهربية للتنبؤ بنوع الرابطة التي ستتشكل. إذا كانت قيم السالبية الكهربائية مختلفة تمامًا عن بعضها البعض ، فستتشكل رابطة أيونية. عادةً ما يكون الكاتيون معدنًا والأنيون هو اللافلزية. إذا كان كل من العناصر معادن ، فتوقع أن تتكون رابطة معدنية. إذا كانت قيم السالبية الكهربائية متشابهة ، فتوقع تشكيل رابطة تساهمية. الروابط بين اثنين من اللافلزات هي روابط تساهمية. تتكون الروابط التساهمية القطبية بين العناصر التي لها اختلافات وسيطة بين قيم السالبية الكهربائية.
كيفية تسمية المركبات - مصطلحات الكيمياء
لكي يتواصل الكيميائيون والعلماء الآخرون مع بعضهم البعض ، تم الاتفاق على نظام التسميات أو التسمية من قبل الاتحاد الدولي للكيمياء البحتة والتطبيقية أو IUPAC. ستسمع مواد كيميائية تسمى أسمائها الشائعة (على سبيل المثال ، الملح والسكر وصودا الخبز) ، ولكن في المختبر ستستخدم أسماء منهجية (مثل كلوريد الصوديوم والسكروز وبيكربونات الصوديوم). فيما يلي استعراض لبعض النقاط الرئيسية حول التسميات.
تسمية المركبات الثنائية
يمكن أن تتكون المركبات من عنصرين فقط (مركبات ثنائية) أو أكثر من عنصرين. تنطبق قواعد معينة عند تسمية المركبات الثنائية:
- إذا كان أحد العناصر معدنًا ، فسيتم تسميته أولاً.
- يمكن أن تشكل بعض المعادن أكثر من أيون إيجابي. من الشائع ذكر الشحنة على الأيون باستخدام الأرقام الرومانية. على سبيل المثال ، FeCl2 هو كلوريد الحديد (II).
- إذا كان العنصر الثاني هو اللافلزية ، فإن اسم المركب هو الاسم المعدني متبوعًا بساق (اختصار) للاسم اللافلزي متبوعًا بـ "ide". على سبيل المثال ، يدعى NaCl كلوريد الصوديوم.
- بالنسبة للمركبات التي تتكون من اثنين من اللافلزات ، يتم تسمية العنصر الأكثر إيجابية للكهرباء أولاً. يتم تسمية جذع العنصر الثاني متبوعًا بـ "ide". مثال على ذلك حمض الهيدروكلوريك ، وهو كلوريد الهيدروجين.
تسمية المركبات الأيونية
بالإضافة إلى قواعد تسمية المركبات الثنائية ، هناك اصطلاحات تسمية إضافية للمركبات الأيونية:
- تحتوي بعض الأنيونات متعددة الذرات على الأكسجين. إذا كان العنصر يشكل أكسجينين ، ينتهي العنصر الذي يحتوي على كمية أقل من الأكسجين بالداخل بينما ينتهي العنصر الذي يحتوي على المزيد من الأكسجين بالداخل. فمثلا:
لا2- هو النتريت
لا3- نترات